鉄は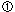 式に示すように水に接するとイオン化 式に示すように水に接するとイオン化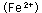 し、水の中に溶け込もうとします。
この時、金属中に電子 し、水の中に溶け込もうとします。
この時、金属中に電子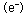 が取り残されます。この電子が取り除かれれば が取り残されます。この電子が取り除かれれば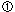 式の反応は進行します。白然界においては、この電子は 式の反応は進行します。白然界においては、この電子は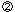 式のように水中の溶存酸素によって取り除かれ、水酸化イオン 式のように水中の溶存酸素によって取り除かれ、水酸化イオン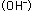 に変化する反応が起きています。この電子を電気的に取り除くのは電気分解であり、水中の水素イオン に変化する反応が起きています。この電子を電気的に取り除くのは電気分解であり、水中の水素イオン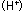 によって取り除くのは酸性水溶液中に
おける水素ガスの発生 によって取り除くのは酸性水溶液中に
おける水素ガスの発生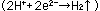 をともなう鉄の溶解です。なお、この水酸化イオンは をともなう鉄の溶解です。なお、この水酸化イオンは 式で示されるように鉄イオンと反応して、水酸化第一鉄 式で示されるように鉄イオンと反応して、水酸化第一鉄 の白濁物となり の白濁物となり 式で示されるように、さらに酸化され、水酸化第二鉄 式で示されるように、さらに酸化され、水酸化第二鉄 の赤褐色の沈澱となります。 の赤褐色の沈澱となります。
この沈澱はコロイド状粒子の集合体をなし、いわゆる赤錆と呼ばれるものですが、鉄表面には密着せず鉄を保護する力がないので、酸素と水とが存在するかぎり錆は進行します。
一方、非鉄金属の酸化被膜のなかには、被膜がち密であり、金属表面との密着性がよく、金属表面を保護するものもあります。たとえば、アルマイトは、アルミニウム表面の酸化被膜を有効的に利用したものであります。 |





